Photo de LUM3N sur Unsplash
Introduction
L’aluminium, élément chimique portant le symbole Al et le numéro atomique 13, est le métal le plus abondant de la croûte terrestre. Troisième élément le plus présent sur notre planète après l’oxygène et le silicium, il est pourtant invisible à l’état pur dans la nature, car il se trouve toujours combiné à d’autres éléments, principalement dans la bauxite. Léger et malléable, il présente une densité environ trois fois inférieure à celle de l’acier.
Cette série présente les éléments du Tableau périodique des éléments chimiques. Ce répertoire, conçu vers 1869 par Dmitri Ivanovich Mendeleïev, rassemble tous les éléments chimiques, qui composent l’univers, tel que nous le connaissons aujourd’hui. L’ingéniosité de ce Tableau tient dans la méthode de répartition des éléments, selon leur numéro atomique, mais aussi selon leurs caractéristiques physiques et chimiques. Ce classement astucieux permet alors d’identifier des éléments existants qui restaient à découvrir, ou même de prédire les propriétés d’éléments chimiques inconnus à l’époque. Sa dernière mise à jour date de 2016, et compte 118 éléments.
Deuxième métal le plus utilisé au monde après l’acier, l’aluminium possède des propriétés physiques exceptionnelles : excellent conducteur électrique — 60 % de la performance du cuivre pour un poids trois fois moindre —, il réfléchit 95 % de la lumière infrarouge et résiste naturellement à la corrosion pendant des siècles, là où le fer rouille en quelques années. Ces caractéristiques en font le matériau de choix pour les applications les plus exigeantes.
Sans aluminium, l’aviation commerciale moderne n’existerait pas. Ce métal compose 70 à 80 % du poids d’un avion de ligne, permettant à ces géants des airs de décoller tout en transportant des centaines de passagers. Dans l’espace, fusées et satellites lui doivent leur légèreté cruciale, et la Station spatiale internationale contient des tonnes de ce métal stratégique.
Pourtant, cette abondance technologique contraste avec sa rareté géologique : il prend des millions d’années à se former dans les gisements de bauxite, qui se trouvent principalement en Australie, en Guinée et au Brésil, avant d’être transformé dans des régions riches en énergie hydroélectrique, comme le Québec.
L’aluminium au passé
— L’aluminium plus précieux que l’or au XIXᵉ siècle
En 1855, l’Exposition universelle de Paris présente au public émerveillé de petits lingots couleur argent, exposés comme des joyaux dans des écrins de velours. Les visiteurs se pressent pour admirer ce métal mystérieux, d’un éclat particulier, qui vaut alors quatre fois plus cher que l’or. C’est de l’aluminium.
Cette valeur — surprenante aujourd’hui — ne résulte pas d’un engouement passager, mais d’une contrainte technique majeure. L’aluminium se trouvant toujours combiné à d’autres éléments, principalement dans la bauxite, il résiste aux tentatives d’extraction des métallurgistes de l’époque.
C’est Henri Sainte-Claire Deville qui, en 1854, parvient le premier à en produire en quantités appréciables. Utilisant le sodium métallique pour réduire le chlorure d’aluminium, le chimiste français réussit à obtenir quelques kilogrammes du précieux métal. Sa méthode ingénieuse demeure coûteuse et complexe, nécessitant des températures élevées et des matières premières onéreuses. Cette production artisanale explique son prix exorbitant : 1 200 francs le kilogramme — contre 300 francs pour l’or.
Napoléon III voit dans l’aluminium un potentiel stratégique, notamment pour des applications militaires, et il devient le mécène de Deville. Il souhaite que les armes, les casques, les armures et autres équipements de l’armée française puissent être fabriqués dans ce nouveau métal léger et brillant.
Parallèlement, le souverain érige l’élément en symbole de prestige à la cour impériale. Lors des banquets officiels, l’empereur fait servir ses invités d’honneur dans de la vaisselle en aluminium, réservant les couverts d’or et d’argent — désormais considérés comme ordinaires — aux convives de moindre importance. Cette hiérarchie inversée témoigne de la fascination qu’exerce ce « métal du futur » sur l’élite parisienne.
Les bijoutiers de la capitale rivalisent de créativité pour offrir des parures en aluminium destinées aux dames de la haute société, et les membres éminents de l’Académie des sciences reçoivent des médailles en aluminium. Et pourtant, en à peine quelques décennies, l’aluminium devient, grâce aux innovations industrielles, l’un des matériaux les plus courants de notre quotidien.

Le Washington Monument a une pointe en aluminium. Sources images: Unsplash, Blogue ‘Art Now and Then’, Pinterest
— La production de l’aluminium : une découverte simultanée de chaque côté de l’océan
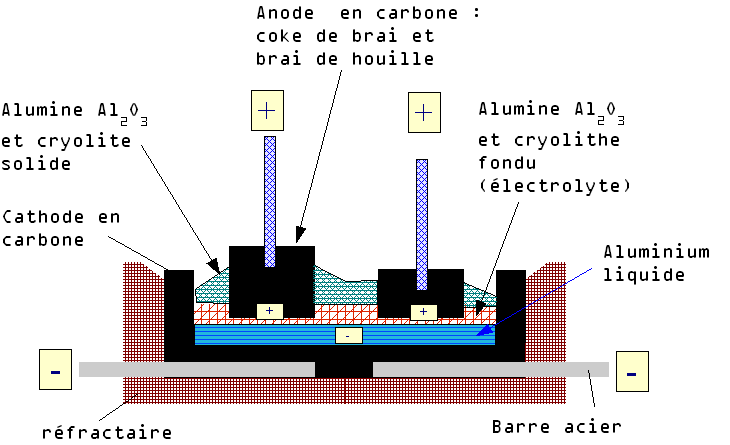
Schéma de la production d’aluminium par le procédé Hall-Héroult. Source : Wikipedia
L’aluminium au présent
— L’aluminium, un vrai papier à deux faces ?
— L’aluminium n’est pas autonettoyant, mais il « s’auto-répare »
Dans la pharmacie
L’avenir de l’aluminium
— L’aluminium, champion du recyclage
— Vers un « aluminium vert » sans carbone

Douglas DC-3 en vol, photographié en 1989. Source image: Wikipedia













