Photo de Alex Larusso sur Unsplash
Introduction
Le carbone, un non-métal réactif, serait connu depuis l’Antiquité, sous forme de graphite et de diamant. Son nom vient du mot latin « carbo », signifiant « charbon de bois ». Son numéro atomique est le 6, et il porte le symbole C.
Cette série présente les éléments du Tableau périodique des éléments chimiques. Ce répertoire, conçu vers 1869 par Dmitri Ivanovich Mendeleïev, rassemble tous les éléments chimiques, qui composent l’univers, tel que nous le connaissons aujourd’hui. L’ingéniosité de ce Tableau tient dans la méthode de répartition des éléments, selon leur numéro atomique, mais aussi selon leurs caractéristiques physiques et chimiques. Ce classement astucieux permet alors d’identifier des éléments existants qui restaient à découvrir, ou même de prédire les propriétés d’éléments chimiques inconnus à l’époque. Sa dernière mise à jour date de 2016, et compte 118 éléments.
À partir du 18e siècle, les chercheurs et scientifiques vont comprendre la nature et les propriétés multiples du carbone. Il constitue plus de composés (combinaisons d’éléments) que l’ensemble des éléments chimiques réunis. Le carbone se trouve dans tous les êtres vivants, de la plus petite bactérie à l’être humain, ainsi que dans presque tout ce qui nous entoure.
À noter : les crayons à mine ne contiennent pas de plomb, mais du graphite. L’appellation « mine de plomb » découle d’une erreur historique remontant au 17e siècle, attribuable à la similitude entre le carbone et le plomb, qui était utilisé pour l’écriture, depuis les Romains.
Le carbone au passé
— Ötzi, l’homme des glaces
Le 19 septembre 1991, dans les Alpes italiennes, des randonneurs allemands font une découverte exceptionnelle : le corps naturellement momifié d’un homme vieux de plus de 5000 ans. On lui donnera le nom d’Ötzi, en référence aux montagnes de l’Ötztal où il est trouvé.
Grâce au carbone 14, les scientifiques peuvent situer sa mort vers 3200 avant notre ère, faisant de lui la plus ancienne momie humaine naturelle jamais découverte en Europe. L’homme des glaces devient une véritable source d’informations sur une période charnière de l’histoire d’homo sapiens. Ce spécimen du Néolithique aurait eu 45 ans, mesuré 1,6 m et pesé autour de 60 kilos.
L’équipement de cet individu, composé notamment d’un arc, de flèches, d’une hache et d’un outil pour le silex, témoigne d’un savoir-faire avancé. Ses vêtements, en cuir et en fourrure, sont élaborés, et ses chaussures sont isolées à l’herbe. Les chercheurs ont pu déterminer qu’il souffrait d’arthrose, de parasites intestinaux et de la maladie de Lyme. Ses poumons étaient noircis, probablement à cause de l’inhalation régulière de fumée de feux de camp. Il portait plusieurs tatouages, peut-être liés à une forme d’acupuncture primitive pour soulager des douleurs articulaires.
Les analyses génétiques d’Ötzi ont confirmé que ses ancêtres étaient des agriculteurs venus d’Anatolie (Turquie actuelle), corroborant les théories sur les migrations néolithiques en Europe depuis le Proche-Orient. En 2013, des chercheurs ont identifié 19 descendants vivants d’Ötzi dans le Tyrol autrichien. Cette découverte démontre la persistance des lignées génétiques sur plus de cinq millénaires, et la continuité des populations alpines depuis la préhistoire.

Reconstitution de la hache en cuivre d’Ötzi.

Réplique d’une chaussure en cuir d’Ötzi. Images : Wikipedia
— Le carbone 14, horloge atomique
En 1940, Martin Kamen et Sam Ruben découvrent le carbone 14 au laboratoire de radiation de Berkeley. C’est Willard Libby qui, en 1949, développe la méthode de datation qui lui vaudra le prix Nobel de chimie en 1960.
Le carbone 14 se forme dans la haute atmosphère, lorsque des neutrons issus du rayonnement cosmique percutent des atomes d’azote. Les organismes vivants absorbent ce carbone 14 en même temps que le carbone 12, dans un ratio constant entre les deux isotopes. À la mort de l’organisme, cet équilibre cesse. Le carbone 14, radioactif, commence à se désintégrer tandis que la quantité de carbone 12 demeure stable. En mesurant le rapport entre ces deux isotopes dans un échantillon, il devient possible de déterminer depuis combien de temps l’organisme ne vit plus. Les techniques utilisées permettent de dater des objets organiques jusqu’à environ 50 000 ans.
Malgré sa précision, la datation au carbone 14 connaît quelques complications. D’une part, les variations de l’activité solaire et du champ magnétique terrestre au fil du temps ont affecté sa production dans l’atmosphère. D’autre part, la combustion massive de combustibles fossiles (voir plus bas) a dilué sa concentration atmosphérique, tandis que les essais nucléaires l’ont artificiellement augmentée. Ces fluctuations nécessitent des corrections complexes pour obtenir des dates précises.
Si le carbone 14 est surtout connu pour son utilité en archéologie, il sert aussi notamment de marqueur biologique et permet d’étudier les variations climatiques, l’évolution du champ magnétique terrestre et les cycles d’activité du Soleil sur plusieurs milliers d’années.
Le carbone au présent
— Le carbone, maître de la métamorphose
Selon l’organisation de ses atomes, un même élément chimique peut exister sous plusieurs formes dans un état physique identique (solide, liquide, gaz). Ces manifestations diverses se nomment allotropes. La nature nous offre trois principales configurations du carbone :
Le diamant, la forme cristalline la plus dense du carbone, se distingue par un réseau d’atomes liés de manière cubique en tétraèdres, sortes de pyramides en trois dimensions. Cette structure lui confère son statut de matériau naturel le plus dur. Cette pierre, d’une clarté exceptionnelle, se distingue en bijouterie. Toutefois, sa résistance en fait un matériau idéal pour certains outils de découpe, et ses propriétés optiques sont très appréciées dans les domaines des hautes technologies et de la recherche scientifique.
Le graphite, doux et malléable, est constitué d’empilements de feuillets de carbone, et cette structure en couches lui permet de se cliver facilement. Chaque feuillet, appelé graphène, forme un réseau hexagonal en nid d’abeilles où les atomes sont liés de façon covalente — plus stables. Cet agencement explique les propriétés conductrices du graphite et sa capacité à servir de lubrifiant solide. Isolé pour la première fois en 2004, le graphène est un meilleur conducteur que le cuivre, et plus résistant que l’acier. Il sert notamment dans l’électronique, le béton, les revêtements anticorrosion et certains dispositifs médicaux. Le marché, estimé actuellement à 150 millions de dollars par an, pourrait atteindre 1,6 milliard de dollars d’ici 2034, selon cet article sur science.org.
Les fullerènes représentent une famille de nanoparticules de carbone aux structures géométriques distinctives. La plus connue, le C60 (composé de 60 atomes de carbone), forme une sphère creuse semblable à un ballon de soccer. D’autres configurations existent : les nanotubes, cylindres microscopiques aux parois ultrafines, et les fullerènes ellipsoïdaux, qui ressemblent à des ballons de rugby. Découvertes en 1985 par Harold Kroto, Robert Curl et Richard Smalley (prix Nobel de chimie 1996), ces molécules révolutionnent plusieurs domaines, de l’électronique à la médecine, en passant par les matériaux de pointe, avec des applications prometteuses dans le stockage d’énergie et la délivrance ciblée de médicaments.
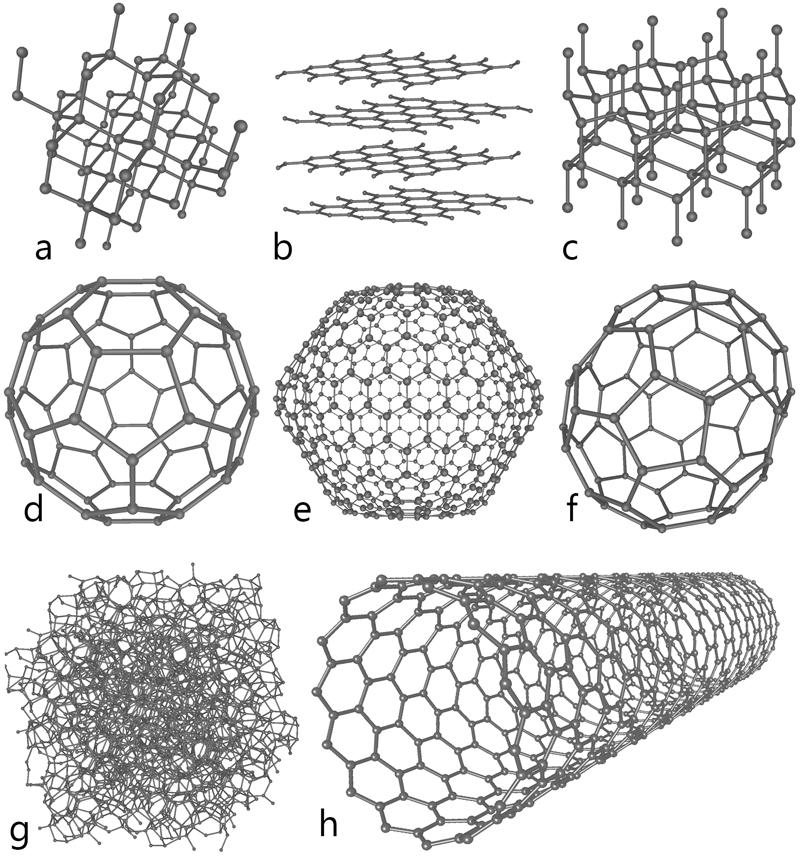
Huit formes allotropiques du carbone : a) diamant, b) graphite, c) lonsdaléite, d) C60 e) C540 f) C70 g) carbone amorphe h) nanotube.
— Les polymères, géants moléculaires du quotidien
Les polymères sont des macromolécules formées par l’enchaînement répétitif d’unités moléculaires. Dans la nature, on les trouve sous forme d’ADN (support génétique), de cellulose (structure des plantes) et de protéines (fonctionnement du vivant).
Leur pendant synthétique se décline en quatre grandes familles : les thermoplastiques (polyéthylène, polypropylène) qui peuvent être refondus, les thermodurcissables (résines époxy) qui durcissent définitivement, les élastomères (caoutchoucs) alliant résistance et souplesse et les fibres synthétiques, comme le polyester, par exemple. Du simple emballage aux plus grands bâtiments, des produits cosmétiques à l’aérospatiale, ils nous entourent et façonnent notre quotidien.
Cependant, ces mêmes caractéristiques de durabilité et de résilience rendent ces matériaux peu ou difficilement biodégradables, donc rapidement encombrants pour l’environnement.
Dans la pharmacie
Pierre angulaire de la chimie organique, le carbone est omniprésent dans notre pharmacie familiale. Les médicaments d’usage courant contiennent du carbone dans leur structure moléculaire, comme le paracétamol (acétaminophène), l’acide acétylsalicylique (aspirine) et l’ibuprofène. Les antibiotiques, les antidépresseurs, ou encore les antihistaminiques sont tous des molécules organiques basées sur le carbone, comme l’immense majorité des médicaments.
Seuls quelques composés minéraux simples ne contiennent pas de carbone. On distingue trois catégories principales :
— Les sels minéraux thérapeutiques : chlorure de sodium (NaCl) ou sulfate de magnésium (MgSO4), dit sel d’Epsom ;
— Les oxydes et composés métalliques : oxyde de zinc (ZnO) dans les crèmes dermatologiques ou oxyde de fer (Fe2O3) dans les suppléments contre l’anémie ;
— Les éléments purs : iode (I) en solution pour la désinfection ou a20rgent (Ag) dans certains pansements antimicrobiens.
Toutefois, ces substances sont généralement formulées avec des excipients (liants, stabilisants, conservateurs) qui, eux, contiennent du carbone. De plus, leur emballage et leur conditionnement incluent probablement des composés carbonés.
Ainsi, chaque fois que nous ouvrons notre armoire à pharmacie, nous manipulons, sans nécessairement en avoir conscience, des produits de la chimie du carbone.
L’avenir du carbone
— Les défis du cycle du carbone
Lorsque des combustibles fossiles, comme le charbon et le pétrole, sont brûlés, ils se transforment en dioxyde de carbone. Et lorsqu’un excès de dioxyde de carbone pénètre dans l’atmosphère, il emprisonne la chaleur du soleil, entraînant la Terre dans un processus connu sous le nom de réchauffement climatique.
Avant l’intervention humaine, le cycle du carbone s’effectuait de manière équilibrée entre l’air, la terre et les océans. Les plantes absorbaient le dioxyde de carbone (CO2) de l’atmosphère pour fabriquer leur nourriture par photosynthèse, relâchant de l’oxygène comme sous-produit. Lorsque ces plantes mouraient ou étaient mangées par des animaux, une partie du carbone retournait dans l’air sous forme de CO2 par respiration ou biodégradation. Une autre partie s’accumulait dans le sol, grâce aux champignons et bactéries qui décomposaient la matière organique en humus, formant un réservoir de carbone. Dans les océans, le plancton jouait un rôle similaire, absorbant le CO2 en surface et l’entraînant dans les profondeurs en mourant.
Sous terre, un processus lent et continu séquestrait le carbone dans les roches et les futurs combustibles fossiles. Ce cycle, vieux de millions d’années, maintenait une concentration stable de CO2 dans l’atmosphère, créant les conditions idéales pour la vie telle que nous la connaissons. Les volcans injectaient périodiquement du CO2 dans l’air, compensé par l’érosion des roches et la sédimentation océanique. Ainsi, la Terre respirait à son rythme.
Depuis la révolution industrielle, l’humanité a bouleversé l’équilibre du cycle du carbone. Trois activités sont en cause dans cette perturbation :
— Combustibles fossiles : la combustion du charbon, du pétrole et du gaz naturel relâche en quelques siècles le carbone stocké pendant des millions d’années ;
— Déforestation : la destruction des forêts, puits de carbones naturels, réduit la capacité de la Terre à absorber le CO2 ;
— Agriculture intensive : l’utilisation excessive d’engrais et le labourage profond libèrent le carbone stocké dans les sols, transformant ces réservoirs naturels en sources d’émissions.
Les conséquences de ce dérèglement sont déjà visibles. Le taux de CO2 atmosphérique a bondi d’environ 280 parties par million (ppm) avant l’ère industrielle à plus de 425 ppm en mars 2024. Les océans absorbent près d’un quart de ce CO2 excédentaire, ce qui provoque une acidification des eaux. Cette transformation menace les organismes à la base des chaînes alimentaires marines, et pourrait déstabiliser l’ensemble des écosystèmes océaniques.
Le réchauffement lui-même engendre un cycle exponentiel : la fonte du pergélisol dans les régions arctiques libère le méthane piégé dans ces sols gelés depuis des millénaires. Ce gaz, au pouvoir réchauffant bien supérieur au CO2, amplifie à son tour l’effet de serre, accélérant encore le changement climatique.
— La hiérarchie des solutions climatiques : éviter, réduire, séquestrer le carbone
L’approche la plus largement préconisée par les différents intervenants propose une hiérarchie d’actions : d’abord éviter, ensuite réduire, et enfin séquestrer les émissions de gaz à effet de serre (GES).
Éviter les émissions signifie repenser nos systèmes et nos manières de vivre, pour empêcher l’ajout de nouveaux GES dans l’atmosphère. Autrement dit, il s’agit de revoir nos modes d’utilisation des énergies fossiles, impliquées dans tous les types d’activités humaines. L’économie circulaire, la réutilisation des objets et l’écoconception (conception de produits durables et réparables) sont quelques pistes de solutions pour moins consommer, de manière générale.
Réduire les émissions concerne une multitude de gestes complémentaires, transformant progressivement nos infrastructures et nos pratiques existantes. L’amélioration de l’efficacité énergétique constitue le premier levier. Les bâtiments à énergie positive, la récupération de la chaleur dans le secteur industriel, la transition vers des sources d’énergie renouvelable ou à faible empreinte carbone (comme le solaire, l’éolien et l’hydroélectricité) et la conversion vers les transports électriques sont autant d’exemples d’actions concrètes pour diminuer l’impact de nos activités sur l’environnement.
Afin de séquestrer le carbone en trop grande quantité dans l’atmosphère, des solutions sont à l’œuvre ou à l’étude :
— Reforestation et afforestation : restauration et création de forêts pour accroître la séquestration naturelle du carbone, et restauration des écosystèmes, avec l’aide de technologies de surveillance par satellite et d’intelligence artificielle ;
— Agriculture régénérative (permaculture) : pratiques agricoles comme l’agroforesterie, par exemple, visant à améliorer la santé des sols et leur capacité à stocker le carbone ;
— Les technologies de capture directe du CO2 dans l’air (Direct Air Capture ou DAC) promettent de réduire à grande échelle sa concentration dans l’atmosphère. Ces systèmes — qui ne feraient pas l’unanimité — couplés à des procédés de valorisation du CO2 capturé pourraient transformer ce gaz à effet de serre en ressource pour l’industrie chimique.

Puits naturel de carbone. Source : Wikipedia
En conclusion, tout est une question d’équilibre !













