Image : DALL.E et Photoshop
Introduction
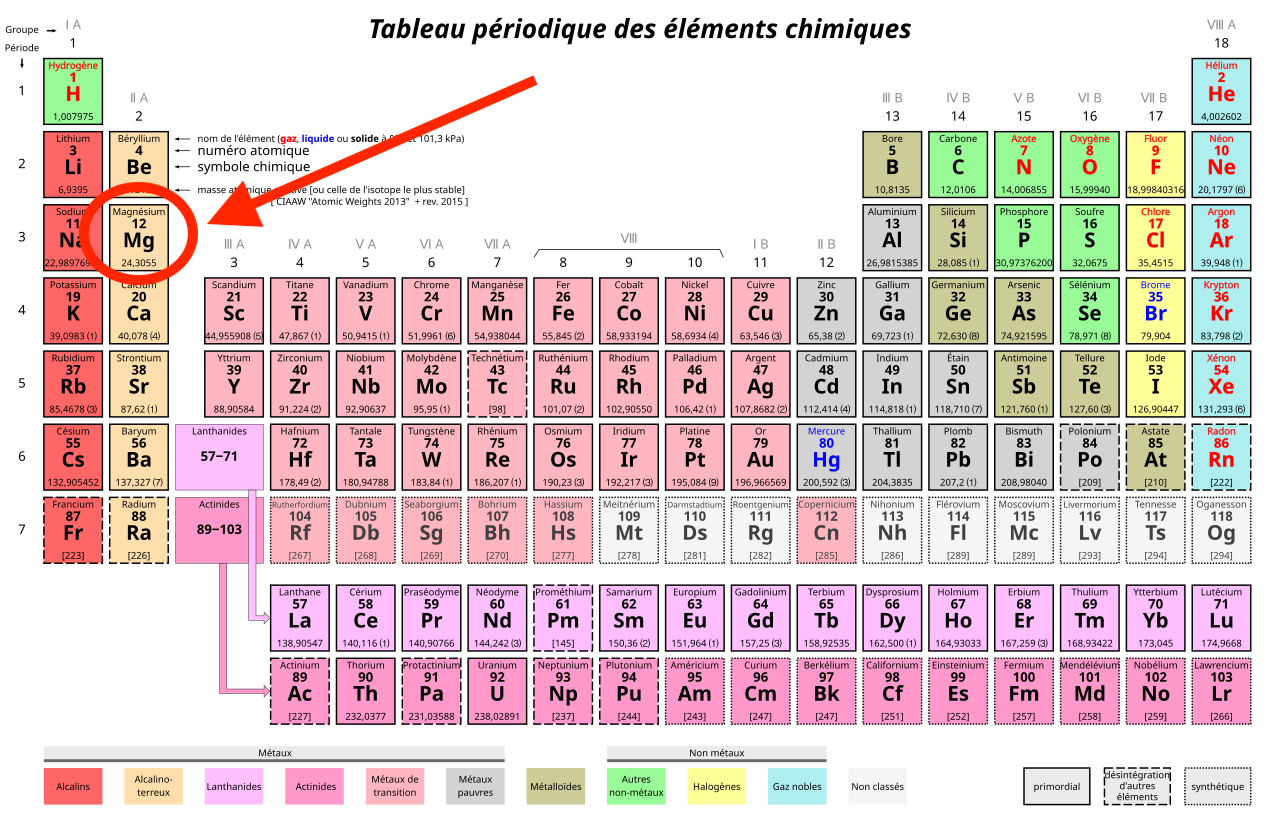
Le magnésium, élément chimique portant le symbole Mg et le numéro atomique 12, est un métal alcalino-terreux léger, résistant, d’une teinte blanc argenté. C’est le huitième élément le plus abondant dans la croûte terrestre, représentant environ 2,33% de sa composition.
Cette série présente les éléments du Tableau périodique des éléments chimiques. Ce répertoire, conçu vers 1869 par Dmitri Ivanovich Mendeleïev, rassemble tous les éléments chimiques, qui composent l’univers, tel que nous le connaissons aujourd’hui. L’ingéniosité de ce Tableau tient dans la méthode de répartition des éléments, selon leur numéro atomique, mais aussi selon leurs caractéristiques physiques et chimiques. Ce classement astucieux permet alors d’identifier des éléments existants qui restaient à découvrir, ou même de prédire les propriétés d’éléments chimiques inconnus à l’époque. Sa dernière mise à jour date de 2016, et compte 118 éléments.
Dans la nature, il n’existe pas à l’état pur, mais combiné à d’autres éléments. Pour l’obtenir sous forme métallique, on procède par réduction ou électrolyse. Hautement réactif sous forme de poudre ou copeaux, le magnésium se couvre d’une couche protectrice d’oxyde lorsqu’il est exposé à l’air, un phénomène appelé passivation, qui réduit sa réactivité. L’industrie l’utilise principalement allié à l’aluminium pour former le magnalium, prisé pour sa légèreté supérieure à l’aluminium pur, et pour sa résistance mécanique et chimique. Il est recyclable à l’infini et conserve toutes ses propriétés, ce qui en fait un matériau durable.
Parmi ses propriétés, notons sa combustion, qui produit une flamme extrêmement vive et blanche, exploitée autrefois dans les flashs photographiques avant l’ère électrique. Une fois enflammé, le magnésium s’avère presque impossible à éteindre car il peut brûler sous l’eau, et même en présence du dioxyde de carbone, en arrachant (et se nourrissant de) l’oxygène contenu dans ces molécules. Ainsi, pour éteindre un incendie impliquant du magnésium, il est impératif d’utiliser du sable ou des extincteurs spécialisés, car l’eau est totalement inefficace et peut même être dangereuse.
Le magnésium au passé
— Le sel d’Epsom : une découverte de plus de 400 ans
Le sel d’Epsom, ou sulfate de magnésium (MgSO₄·7H₂O), tire son nom de la ville anglaise du même nom. Durant l’été sec de 1618, Henry Wicker, fermier local, remarque que ses vaches refusent de boire l’eau d’un puits, malgré leur soif. On peut supposer que le fermier goûte alors lui-même cette eau, et qu’il note son amertume distinctive. Les premiers consommateurs curieux constatent rapidement ses effets laxatifs. L’idée circule qu’il pourrait s’agir d’une eau aux vertus médicinales. La rumeur se répand, et les habitants de la région découvrent que cette eau soulage les douleurs musculaires et articulaires lorsqu’on s’y baigne. Dès les années 1630, la réputation de ses sources transforme Epsom en station thermale, la première en Angleterre à vendre son eau minérale.

L’emplacement du puits originel d’Epsom. Source : Wikipedia
— De la magnésie au magnésium
Le terme « magnésium » provient de Magnésie en Grèce, région riche en minéraux tels que la magnésite (carbonate de magnésium) et la magnétite (oxyde de fer). La magnésite était connue pour ses propriétés médicinales depuis l’Antiquité. Le magnésium en tant qu’élément a connu une histoire de découverte en deux temps. Au milieu du XVIIIe siècle, la science de la chimie est en pleine transformation, passant de l’alchimie à une discipline plus rigoureuse, fondée sur des observations méthodiques et des expériences contrôlées. C’est dans ce contexte que Joseph Black, chimiste et physicien écossais, démontre en 1755 la différence entre la magnésie (oxyde de magnésium, MgO) et la chaux (oxyde de calcium, CaO), deux poudres similaires en apparence. Black établit ainsi les bases permettant d’identifier le magnésium comme élément distinct. En 1808, Sir Humphry Davy, pionnier de l’électrochimie, parvient à l’isoler pour la première fois. Il utilise l’électrolyse pour décomposer la magnésie et obtenir le magnésium métallique. Cette méthode, qu’il avait déjà employée avec succès pour isoler le potassium et le sodium quelques années plus tôt, confirme la nature élémentaire du magnésium.

Lampe à poudre de magnésium, Allemagne, vers 1865. Source : cameramuseum.ch
Le magnésium au présent
— Le magnésium, chef d’orchestre biologique
Participant à plus de 300 réactions biochimiques dans le corps humain, le magnésium opère comme un véritable chef d’orchestre, assurant que chacune se déroule harmonieusement. Voici quelques exemples :
— La production énergétique
Le magnésium est indispensable à la production et au bon fonctionnement de l’ATP (adénosine triphosphate), principale source d’énergie des cellules. Cette molécule agit comme un « carburant » cellulaire, mais elle ne peut libérer son énergie qu’en présence de magnésium. Sans lui, l’ATP serait comme un moteur privé de ses bougies d’allumage, incapable de démarrer efficacement.
— La synthèse des protéines
Chaque cellule fonctionne telle une usine complexe, fabriquant en continu des protéines nécessaires à la croissance, à la réparation et au bon fonctionnement du corps. Le magnésium stabilise et active les ribosomes, chargés d’assembler les acides aminés en protéines. Sans magnésium, ce serait comme construire un immeuble sans architecte ni plans : tout s’effondre.
— Le rythme cardiaque
Le cœur est un muscle particulier qui doit demeurer en mouvement, alternant entre contraction et relâchement pour maintenir un rythme régulier. Le magnésium joue ici un rôle crucial en assurant que le muscle cardiaque puisse se relâcher après chaque contraction. De même pour les autres muscles du corps, il agit un peu comme une soupape pour éviter les contractions prolongées, prévenant les crampes et les spasmes musculaires.
— L’équilibre nerveux
Le magnésium est en partie responsable de l’équilibre nerveux, en régulant la production de cortisol, souvent appelée « hormone du stress ». Lorsqu’il se trouve en excès, le cortisol peut entraîner anxiété, troubles du sommeil et fatigue chronique. Le magnésium intervient en modérant la libération de cette hormone. Par ailleurs, il stimule la production de GABA (acide γ-aminobutyrique), un neurotransmetteur aux effets apaisants qui contribue à calmer le système nerveux.
— Des os solides
Le calcium est connu pour son importance dans la santé des os. Pourtant, sans magnésium, il ne peut être correctement assimilé ni utilisé par l’organisme. Le magnésium guide le calcium vers les os, favorisant leur solidité, tout en empêchant qu’il ne se dépose dans les artères où il pourrait causer des dommages. Ce tandem est donc essentiel pour maintenir à la fois une ossature robuste et un système cardiovasculaire sain.
— La régulation du glucose
Chaque repas apporte des glucides, transformés en glucose, une source d’énergie indispensable pour les cellules. Toutefois, sans régulation efficace, ce sucre devient problématique. Le magnésium intervient en optimisant l’action de l’insuline, hormone qui contrôle l’entrée du glucose dans les cellules. Lorsque le magnésium intracellulaire est insuffisant, l’activité des récepteurs à l’insuline est perturbée. Sans magnésium, la cellule serait comme une voiture sans courroie de transmission : le moteur tourne dans le vide, le glucose reste bloqué à l’extérieur, et tout le métabolisme est à l’arrêt.
— Le magnésium et la couleur verte des plantes
Le magnésium est l’atome central de la chlorophylle, molécule qui donne aux plantes leur couleur caractéristique. Logé au centre d’un anneau complexe appelé porphyrine, notre élément stabilise toute la structure moléculaire.
Grâce à cette configuration, la chlorophylle peut capter efficacement les longueurs d’onde bleues et rouges du spectre lumineux, tout en réfléchissant la lumière verte – c’est pourquoi les plantes nous apparaissent vertes. Ce mécanisme de filtrage sélectif optimise la captation de l’énergie solaire.
Une fois l’énergie lumineuse interceptée, une séquence de réactions chimiques se déclenche et transforme l’eau et le dioxyde de carbone en glucose et en oxygène. Ce processus fondamental, la photosynthèse, constitue non seulement la base de l’alimentation des plantes, mais aussi la source de l’oxygène atmosphérique.
Lorsqu’une plante manque de magnésium, les feuilles plus anciennes jaunissent entre les nervures qui restent vertes, créant un motif marbré caractéristique appelé chlorose. Ce dépérissement progressif témoigne de l’incapacité croissante de la plante à synthétiser la chlorophylle et donc à capter l’énergie solaire. Sans intervention, la plante s’affaiblit, sa croissance ralentit, et sa productivité diminue.
Ce lien étroit entre magnésium et chlorophylle illustre bien l’interdépendance entre monde minéral et monde végétal, et il démontre combien un seul élément chimique est indispensable à l’équilibre de la vie sur Terre.
🌱
Dans la pharmacie
Les médicaments les plus courants contenant du magnésium incluent notamment :
• Le sel d’Epsom (sulfate de magnésium, MgSO₄⋅7H₂O) : vu plus haut, utilisé comme laxatif ou dans les bains thérapeutiques pour soulager les douleurs musculaires, le stress ou l’inflammation légère.
• Le lait de magnésie (hydroxyde de magnésium, Mg(OH)₂) : laxatif et antiacide couramment employé pour traiter la constipation occasionnelle et les brûlures d’estomac.
• Les antiacides : ils contiennent souvent de l’hydroxyde ou du carbonate de magnésium (MgCO₃), destinés à soulager les reflux gastro-œsophagiens, les indigestions et les brûlures d’estomac.
• Les suppléments multivitaminiques ou minéraux : ils intègrent fréquemment du citrate (Mg₃(C₆H₅O₇)₂), du glycinate (Mg(C₂H₄NO₂)₂) ou du carbonate de magnésium, chaque forme ayant ses spécificités.
Avant de choisir un supplément de magnésium ou tout autre supplément nutritionnel, il est recommandé de consulter un professionnel de la santé, comme votre pharmacien ou pharmacienne.
L’avenir du magnésium
— Des batteries au magnésium
Le développement de batteries au magnésium suscite un intérêt croissant dans le domaine des nouvelles énergies, car ce métal est plus abondant, moins cher et plus sécuritaire que le lithium actuellement utilisé. Toutefois, plusieurs défis techniques restent à relever. Parmi eux, la conception d’électrolytes efficaces, facilitant la circulation des ions magnésium, et le choix de matériaux de cathode adaptés.
Des avancées récentes à l’Université de Waterloo ont permis de créer un électrolyte innovant, augmentant la tension à près de trois volts, comparable aux batteries lithium-ion actuelles. À titre de comparaison, les premières recherches sur les batteries au magnésium ne produisaient qu’environ un volt, soit moins qu’une pile AA standard (1,5 V). Parallèlement, des chercheurs à l’Université des sciences de Tokyo étudient des cathodes dotées d’une structure spinelle qui améliore la circulation et le stockage des ions dans les batteries.
Malgré ces progrès, des obstacles persistent. Les ions de magnésium portent une double charge positive, ce qui les rend très réactifs avec les matériaux des cathodes et ralentit leur déplacement à travers la batterie, diminuant ainsi ses performances. De plus, les électrolytes actuels ont tendance à former des couches solides indésirables à la surface des électrodes, freinant davantage le déplacement des ions. Ces batteries prometteuses nécessitent encore quelques progrès avant de devenir une solution commerciale — et environnementale — viable.
— Des implants au magnésium biodégradables dans l’organisme
Le magnésium pourrait bientôt s’imposer dans le domaine prometteur de la médecine régénérative en raison de sa biocompatibilité et de ses propriétés mécaniques proches de celles de l’os humain. Des équipes scientifiques évaluent son potentiel dans la conception d’implants capables de se dissoudre naturellement dans l’organisme après avoir accompli leur tâche. Ces dispositifs, fabriqués à partir d’alliages à base de magnésium, pourraient éliminer la nécessité d’une seconde opération chirurgicale pour retirer les implants, réduisant les risques pour les patients, et les coûts liés aux soins médicaux.
Les recherches en cours explorent notamment l’utilisation de ces implants biodégradables pour stabiliser des fractures complexes, ou comme supports provisoires dans les chirurgies cardiovasculaires. Une fois leur fonction remplie, ils seraient lentement assimilés par le corps, laissant place à une régénération complète des tissus. Des études ont démontré que les ions de magnésium libérés lors de la dégradation de l’implant peuvent stimuler la formation osseuse.
Si les résultats continuent d’être encourageants, cette innovation pourrait transformer la prise en charge de nombreuses affections chirurgicales, favorisant une guérison plus naturelle, plus sûre et moins invasive.

Des aliments qui contiennent du magnésium.













